belajarbersamaindah
Thursday, July 22, 2021
Monday, September 14, 2020
HUKUM FARADAY 1 - ELEKTROKIMIA PART 5
Hukum Faraday I berbunyi, “Massa zat yang dibebaskan pada elektolisis berbanding lurus dengan jumlah listrik yang digunakan.” atau w = Q (massa = listrik)
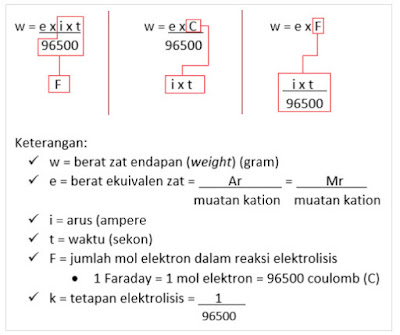
A. Rumus hukum Faraday I
Dalam perhitungan elektrolisis hukum Faraday I, sering sekali digunakan mol elektron karena mol elektron berguna sekali di reaksi di katode dan anode (ingat, bahwa elektron menyebar merata di reaksi elektrolisis!)
RUMUS-RUMUS HUKUM FARADAY I
B. Pengukuran pH memakai hukum Faraday I
Dalam perhitungan pH, yang diperlukan adalah konsentrasi ion proton ([H+]) atau konsentrai ion hidroksida ([OH-]). Nah, biasanya dalam perhitungan pH hukum Faraday I digunakan suatu asam/basa kuat. Berikut catatan pentingnya:
- Jika diketahui satuan coulomb (ex = 965 C) maka bisa didapatkan mol elektron, dari persamaan C/96500 (lihat rumus di atas!)
- Apabila diketahui volume, ubah ke mol dahulu
- Selalu hubungkan pengukuran pH dengan mol elektron karena mol elektron di katode sama dengan di anode sebab aliran elektron dalam wahana elektrolisis sama dikedua kutub
- Perhitungan pH akan lebih mudah jika banyak latihan
CONTOH SOAL:
- Pada penyepuhan logam besi dengan tembaga digunakan larutan CuSO4 dengan arus 2 A selama 30 menit. Massa tembaga murni yang mengendap di katode sebesar … gram (Ar Cu = 63,5)
–> Penyelesaian:
A. 96.500
B. 19.300
C. 1.930
D. 965
E. 482,5
–> Pembahasan:
3. Pada elektrolisis larutan CdSO4 menggunakan elektrode karbon, terbentuk endapan Cd sebanyak 2 gram (Ar Cd = 112) pada katode. Volume oksigen (STP) yang dihasilkan pada anode sebanyak … liter.
B. 0,4
C. 0,5
D. 0,6
E. 0,8
–> Pembahasan:
4. Pada elektrolisis leburan kalsium klorida dengan elektrode karbon, digunakan muatan listrik sebanyak 0,02 F. Volume gas klorin (STP) yang dihasilkan di anode jika diukur pada suhu dan tekanan di mana 1 liter gas N2 (Mr = 28) massanya 1,4 gram, adalah …
B. 200 mL
C. 224 mL
D. 400 mL
E. 448 mL
–> Pembahasan:
5. Elektrolisis larutan MSO4 dilakukan dengan elektrode karbon. M bukan logam aktif. Pada katode terbentuk 0,12 gram M larutan hasil elektrolisis yang dapat dinetralkan oleh 50 mL larutan NaOH 0,2 M. Massa atom relatif M yaitu …
B. 36
C. 48
D. 60
E. 72
–> Pembahasan:
6. Arus listrik sebanyak 9.650 C dialirkan melalui 1 liter larutan perak nitrat 1 M selama beberapa waktu dalam sebuah sel elektrolisis. Bila kedua elektrode terbuat dari Pt, volume larutan dianggap tetap, maka pH larutan setelah elektrolisis selesai adalah …
B. 1
C. 2
D. 3
E. 4
–> Pembahasan:
Friday, September 11, 2020
ELEKTROKIMIA PART 4. ELEKTROLISIS
KONSEP ELEKTROLISIS
Sama dengan sel volta, pada elektrolisis, katoda adalah elektroda tempat terjadinya reaksi
reduksi dan anoda adalah elektroda tempat terjadinya reaksi oksidasi. Akan tetapi, pada
elektrolisis, katoda adalah kutub negatif sedangkan anoda adalah kutub positif. Berikut adalah
reaksi-reaksi yang terjadi pada katoda dan anoda sel elektrolisis yang bergantung pada wujud
zat, jenis kation dan anion, dan jenis elektroda.
Elektrolisis adalah penguraian suatu elektrolit oleh arus listrik. Pada sel elektrolisis. Reaksi kimia akan terjadi jika arus listrik dialirkan melalui larutan elektrolit, yaitu energi listrik (arus listrik) diubah menjadi energi kimia (reaksi redoks).
Faktor-faktor terjadinya reaksi-reaksi elektrolisis
- Spesi yang mengalami reduksi di katode adalah yang mempunyai potensial reduksi (E°) lebih positif (+)
- Spesi yang mengalami oksidasi di anode adalah yang mempunyai potensial oksidasi (E°) lebih negatif (-)
- Jenis elektrode, inert (tidak dapat bereaksi; ex = Pt, C, Au) atau aktif (dapat bereaksi sempurna)
- Potensial tambahan yang diperlukan sehingga reaksi elektrolisis dapat berlangsung (overpotensial)
- Dalam reaksi-reaksi elektrolisis ditemukan gas-gas yang terbentuk, yaitu gas hirogen, oksigen, fluor, dan klor.
A. KATODA
Apabila suatu elektrolit dielektrolisis, maka kation akan mengalami reduksi di katoda.
Reaksi yang terjadi di katoda ditentukan oleh wujud zat (larutan atau leburan) dan jenis
kation.
Anoda adalah tempat reaksi oksidasi. Komponen yang teroksidasi bergantung pada jenis
anoda dan jenis anion.
CONTOH SOAL REAKSI ELEKROLISIS
1. Elektrolisis terhadap larutan berikut ini yang dapat menghasilkan gas hidrogen di anode adalah …
A. AgNO3 (aq)
B. Na2SO4 (aq)
C. NaH (aq)
D. MgCl2 (aq)
E. KI (aq)
A. AgNO3 (aq)
B. Na2SO4 (aq)
C. NaH (aq)
D. MgCl2 (aq)
E. KI (aq)
Pembahahasan
2. Lelehan Al2O3 dielektrolisis dengan elektrode grafit (C) pada kedua batang yang dicelupkan seperti pada gambar.
Reaksi yang terjadi di X adalah …
A. 2O^2- –> O2 + 4e
B. Al3+ + 3e –> Al
C. 2H2O –> 4H+ + O2 + 4e
D. 4OH- –> 2H2O + 4e + O2
E. 2H2O + 2e –> 2OH- + H2
–> Pembahasan:
Susunan elektrolisis pada gambar dicelupkan elektrode C, artinya elektrode tidak bereaksi pada anion. Sip. Pada bagian X adalah reaksi yang terjadi pada kutub positif, yaitu anode. Nah, pada anode pasti terjadi proses reduksi jenis anion. Pada soal terdapat senyawa Al2O3, yang terdapat kation Al^3+ dan anion O^2-. Nah, anion O^2- bukan termasuk sisa asam oksi, maka
- anion O^2- yang teroksidasi, maka jawaban paling tepat adalah A.
- Pada elektrolisis larutan NaCl dengan elektrode platina (Pt), di katode terjadi reaksi …
A. Na^+ + e –> Na
B. 2Cl^- –> Cl2 + 2e
C. NaCl –> Na^+ + Cl^-
D. 2H2O –> 4H+ + O2 + 4e
E. 2H2O + 2e –> H2 + 2OH-
–> Pembahasan:
Elektrolisisnya dilakukan terhadap “larutan” NaCl, artinya air bisa saja tereduksi atau teroksidasi di reaksi ini. Namun, elektrode platina adalah elektrode inert dan tidak ikut bereaksi. Nah, karena yang ditanya reaksi di katode (kation), maka kationnya adalah ion Na+ dan termasuk logam aktif, maka air yang tereduksi. - Pada elektrolisis cairan natrium klorida, pada katode dan anode berturut-turut dibebaskan …
A. H2 dan Cl2
B. H2 dan O2
C. Na dan Cl2
D. Na dan H2
E. Na dan O2
–> Pembahasan:Elektrolisis “cairan” sama dengan lelehan, artinya air maupun elektrode tidak ikut tereduksi atau teroksidasi. Natrium klorida (NaCl) memiliki kation Na+ dan anion Cl-. Nah, terjadi reaksi:
*Katode: Na+ + e –> Na
*Anode: 2Cl- –> Cl2 + 2e - Ketika larutan encer air garam dielektrolisis, suatu gas tidak berwarna dilepaskan dari anode. Gas tersebut adalah …
A. Uap
B. Klorin
C. Oksigen
D. Hidrogen
E. Karbon dioksida
–> Pembahasan:
Larutan air garam belum tentu mempunyai rumus NaCl, karena NaCl adalah garam dapur, bukan air garam. Nah, pada elektrolisis air garam, gas yang timbul di anode adalah hasil dari teroksidasinya air, artinya pada anode air garam adalah sisa asam oksi. Reaksi di anode pada sisa asam oksi adalah 2H2O –> 4H+ + O2 + 4e; dilepaskan gas oksigen. - Suatu larutan tembaga (II) sulfat dielektrolisis menggunakan elektrode karbon. Endapan berwarna kemerahan yang terbentuk pada salah satu elektrode adalah …
A. Tembaga
B. Tembaga (I) oksida
C. Temaga (II) oksida
D. Tembaga (II) sulfida
E. Tembaga (III) sulfida
–> Pembahasan:
Tembaga (II) sulfat, CuSO4, dielektrolisis dengan elektrode karbon, maka elektrodenya tidak bereaksi di anode dan katode. Nah, Endapan berwarna kemerahan dimiliki oleh unsur tembaga, yaitu di katode sesuai reaksi Cu2+ + 2e –> Cu.
Tuesday, August 4, 2020
Tuesday, July 28, 2020
Subscribe to:
Comments (Atom)
-
Selama reaksi kimia berlangsung, akan terjadi aliran elektron yang menghasilkan energi listrik. Peralatan yang dapat mengubah energi kimia ...
-
Michael Faraday adalah penemu hukum Faraday dan benzena. Ia menemukan hukum Faraday jauh sebelum ditemukannya elektron. Dalam penemuannya, ...
-
KONSEP ELEKTROLISIS Sama dengan sel volta, pada elektrolisis, katoda adalah elektroda tempat terjadinya reaksi reduksi dan anoda adalah el...